Проблемът за елементите и тяхната класификация в химичната история.
Част III. Oт морозов до Томсън
Кирил Б. Гавазов
1.
Прозренията на Морозов
2.
Дискусията за аргона
3.
Въвеждането на нулева група
4.
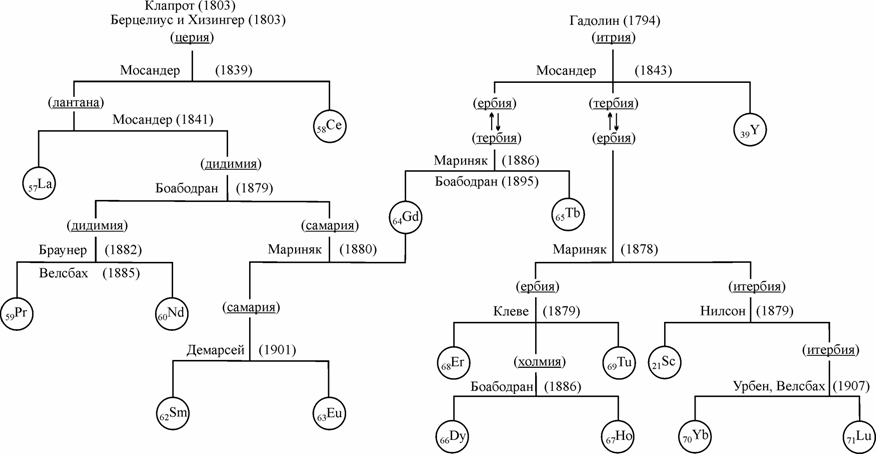
Проблемът за редкоземните елементи
5.
Лъчите на Бекерел
6.
Синовете на Кюри
7.
Атомът – сложна частица
8.
Първите атомни модели
1. Прозренията на Морозов
След откриването на галия,
скандия и германия периодичният закон на Менделеев като че ли стабилно се
утвърждава в науката и нищо не предвещава сериозни сътресения в устоите му. Проблеми
с поместването на новооткрити елементи в периодичната система по това време не
се очакват, а догатките на Менделеев от 1869 г. за съществуването на четноатомни елементи (т.е. елементи с
четна валентност) с атомни тегла 2, 20 и 36, разположени между халогенните и
алкалните елементи са напълно забравени от великия учен. Все пак указания за
съществуването на такива елементи, както показва литературният анализ от
по-късни времена, не липсват. При съпоставяне на елементите от първите периоди
и тяхната атомност, както е показано
по-долу, може да се забележи прекъсване на редуването на нечетноатомни и четноатомни
елементи на границата между два периода.
атомност (валентност): 1 ½ 1 2 3 4 3 2 1 ½ 1 2 3
4
3 2 1 ½ 1 2 3 4 …
елемент: H Li Be B C N O F Na Mg Al C P S Cl K Ca Ga Sn …
Освен това броят на четноатомните елементи в границите на даден период (четири) е с
единица по-малък от този на нечетноатомните (три). Тази разлика подсказва, че числовия
ред може да е непълен и добавянето на нули на местата означени с „½” изглежда логично. Такова допълване би характеризирало
съответните елементи като нулеви, безвалентни
и химично неутрални.
До подобен извод по времето на
Менделеев би могло да се стигне и по друг начин. Очевидно е, че преходът в
свойствата на елементите от големите периоди на системата от една полярна
крайност до друга (напр. от К до Br) се извършва плавно и последователно, а преходът между
два периода – със скок. Ако се предположи, че между
хлора и калия съществува нeизвестен
елемент (с предполагаема атомна маса 36), то трябва да се очаква, че този
елемент ще обуславя прехода между някаква отрицателна величина (характеризираща
химизма на халогена) и подобна по абсолютна стойност положителна величина
(характеризираща химизма на алкалния метал). В крайна сметка резултантната
величината, характеризираща неизвестния елемент ще е нула и този елемент ще е „бездеен”.
Съществуването на инертните газове
и тяхното основно свойство – да не образуват съединения е предсказано в
началото на 90-те години на XIX век по оригинален и доста любопитен начин от
руският учен Николай Александрович Морозов (1854-1946). Осъден на доживотна
каторга през 1882 за участие в заговор срещу Александър II, в пълна изолация от научния свят, той пише книгата „Периодичните системи за строежа на веществото. Теория за образуване на
химичните елементи”, в която обръща внимание на аналогията между периодичната система на химичните елементи
и периодичната система на въглеводородните
радикали. Тази аналогия му дава основания да добави допълнителна колонка в
таблицата на Менделеев. В новата колонка Морозов поставя неизвестни елементи с атомни
тегла 4, 20, 36 (или 40) и 82 предполагайки, че те са неактивни газове подобни
на метановите въглеводороди. Той счита,
че тези елементи могат да се открият в атмосферата, „в случай, че не са се разложили при условията на образуване на Земята”
(догатка за съществуване на явлението радиоактивност).
Морозов моли управата на
затвора да предаде ръкописа на Д. Менделеев или Н. Бекетов (1827-1911), но
молбата му не е удовлетворена. Все пак, с голямо закъснение, книгата на Морозов
вижда бял свят. Тя е издадена през 1907 г., когато групата на нулевите газове вече
е неотменна част от периодичната система. В приложението към книгата, озаглавено
„Безусловната необходимист от хелия и
неговите аналози за нашата структурна теория и тяхното последващо откритие”
авторът пише: „Велика бе моята радост,
когато за пръв път до мен достигна веста за откритието на Рамзи и лорд Рейли на
първия вестител на тази неизвестна серия елементи – аргонът! В самия момент,
когато научих, че неговото атомно тегло е близко до 40, той беше регистриран от
мен на същото това място в периодичната система на Менделеев (допълнена на
основата на моите структурни представи с отсъстващата пълна 8-ма колонка),
където той се намира и сега. След това аз ни най-малко не се съмнявах, че ще
бъдат открити и всички останали елементи от тази необходима за мен серия, и
откриването на всеки нов неин член беше за мен истински празник.”
2. Дискусията за аргона
Откриването на първия
представител на новата група – аргонът става в интервала 1892-1894 г. То е провокирано
от наблюдаваната от Джон Рейли (1842-1919) разлика в плътностите на азота,
получен по химичен път и този, отделен от атмосферния въздух. Рейли не може да обясни
този необичаен факт и чрез страниците на списание „Природа” кани химиците да
потърсят отговор на въпроса. Пръв се отзовава лорд Уйлям Рамзи (1852-1916),
който съвместно с Рейли започва да експериментира със значителни количества
въздух, предполагайки, че атмосферната фракция, считана за
азот, всъщност е смес от два елемента.
През 1894 г. двамата учени успяват да изолират нов елемент от тази фракция,
използвайки факта, че азотът реагира с магнезий при накаляване. Изключителната
инертност на новия газ им дава основание да го нарекат аргон (от гр. a-ergon – бездеен, неактивен). С определянето на атомната му маса (А=40),
обаче, възникват сериозни въпроси, за чието изясняване са нужни няколко години.
В последвалата дискусия, касаеща разполагането му в периодичната система се открояват
четири различни мнения:
1) Аргонът е част от триада (X1 X2 X3) в VIII-ма група, подобна на триадата Fe, Co, Ni.
2) Аргонът е уплътнен
(полимеризиран) азот – N3, който са отнася към обикновения азот (N2), както озонът О3
към кислорода (О2).
3) Аргонът е осематомен елемент от група, която се
намира между групата на халогените и групата на алкалните метали.
4) Аргонът е елемент от нова т. нар. нулева
група, която се намира между групата на халогените и групата на алкалните
метали.
Първото мнение е поддържано от
откривателите на новия газ Рейли и Рамзи. Определяйки топлинния му капацитет,
те решават, че той се състои от единични атоми и не е съединение. Двамата учени
продължават с експериментите и се надяват скоро да открият и другите два липсващи
елемента от предполагаемата триада.
Второто мнение първоначално е
предложено от Дюар, а впоследствие е подкрепено с допълнителни аргументи от
Менделеев и Л. Майер. Менделеев първоначално залага на факта, че утроеното
атомно тегло на азота добре съвпада с намереното за аргона. За него елементарността
на новото вещвство е малко вероятна, тъй като атомното му тегло (А=40) изисква поместване
между калия (39,1) и калция (40,1). А там, очевидно, свободно място няма. Той
отхвърля и хипотезата, че аргонът е част от триада (подобна на Fe, Co, Ni) – последната се
състои от метали, а не от газове (и то с инертни свойства).
Третото мнение е защитено от
Льокок дьо Боабодран. В своята статия „Бележка
за атомните тегла” (март 1995) Боабодран пише: „Веществото, открито толкова блестящо от лорд Рейли и проф. Рамзи, може
би заема място в група елементи, съществуването на която не е известно от
по-рано. Такава група, а нейното съществуване е вероятно съгласно класификацията
ми, трябва да съдържа елементи с неметална природа и атомни тегла 20,0945; 36,40±0.08;
84,01±0,20;
132,7±0,15,
ако изхождаме от атомно тегло на кислорода =16. Атомността на новата група
трябва да е еднаква (осематомна), обаче влизащите в нея елементи трябва да са
лишени от способността да се съединяват с други елементи.” Въпреки, че Боабодран се престарава, предвиждайки
атомните маси с точност до втория или дори до четвъртия знак, не може да не се признае фактът, че той се
оказва най-близо до истината.
Четвъртото мнение, формулирано
за пръв път (октомври 1895) от Владимир Кистяковский (1865-1952) се доближава в
известна степен до това на Боабодран. Кистяковский обаче не счита новия газ за
осематомен. В писмо до Вилхем Оствалд (1853-1932), редактор на известно научно списание,
Кистяковский посочва, че „съгласно всички
проведени досега изследвания, аргонът не образува химични съединения –
химичната му значност [атомност, валентност] е нула” и строи съответния участък от периодичната система
по начина представен на таблица 1. За съжаление обаче Кистяковский не споменава
в своя ръкопис нищо за елемента хелий, който е открит на земята няколко месеца
по-рано (виж по-долу). Ето защо статията му не е отпечатана.
Таблица 1. Въвеждане на нулевата група от В. А. Кистяковский
в „Място на аргона в периодичната система”.
Със символа А е означен аргонът, а с АI и AII – неговите по-тежки,
неоткрити все още аналози.
|
Химична значност
|
|
|
|
|
|
|
|
0
|
|
(36-39)
A
|
(81-85)
AI
|
(128-132)
AII
|
…
|
Атомно тегло
|
|
1
|
Li
|
K
|
Rb
|
Cs
|
|
|
|
2
|
Be
|
Ca
|
Sr
|
Ba
|
|
|
|
3
|
B
|
Sc
|
Y
|
La
|
|
|
3. Въвеждането на нулева група
Историята на откриване на
хелия започва през 1868 г., когато при слънчево затъмнение двама независими
наблюдатели – Пиер Жансен (1824-1907) и Джозеф Локер (1836-1920) откриват в
спектъра на слънчевата корона непозната жълта линия (означена като D3). Въпреки мнението на
химиците, че това най-вероятно е линия на натрия, Локер обявява (три години по-късно), че тя принадлежи на нов метал. Той го нарича хелий по гръцката дума ¸lios – слънце и окончанието за метали –ий (лат. -um). Впоследствие линията на слънчевия елемент е регистрирана и в земни проби
– газове, отделени от вулканичните скали на Везувий (1881) и уранови минерали. През март 1895 г. У. Рамзи изследва газовете
отделени от една разновидност на уранинита (клевеит)
и изолира от сместа нов газ с аргоноподобни свойства и атомно тегло близко до
4. Той изпраща проба от този газ {с пилотното име криптон
– от гр. 6DLBJ`H (скрит)} на всепризнатия спектроскопист Крукс (виж част II), който му отговаря с телеграма: „Криптонът е хелий 58749 елате и вижте” Отзовавайки
се на поканата, Рамзи разбира смисъла
на загадъчното число. Това е дължината на вълната на жълтата линия D3 (в стомилионни части от
сантиметъра).
В този момент инертните газове
стават два, а мнението на Боабодран привлича нови привърженици. Разбира се има
учени, които продължават да настояват, че аргонът е уплътнен азот (N3). Те разглеждат хелия като уплътнен водород (H3 или H4) чак до 1898 г., когато Рамзи и Морис Трейвърс (1872-1961) откриват три нови
елемента – аналози на аргона и хелия: криптон,
неон и ксенон.
Ето как Рамзи описва откриването
на тези газове в своя „Автобиографичен очерк”: „... Хампсън ни достави около 100 cm3 течен
въздух. След като по-голямата част от това количество беше превърнато в пара,
ние изследвахме остатъка и намерихме в него газ, даващ две блестящи спектрални
линии – жълта и зелена. Плътността му беше
по-голяма от плътността на аргона, именно около 22,5. Ние го нарекохме криптон (скрит). Трейвърс получи
около 15 литра аргон ... Когато ние го превърнахме в течно състояние, с помощта
на втора порция течен въздух, доставен от Хампсън, то първите изпаряващи се
части започнаха да светят с ярка огнена светлина, когато през тях преминаваше
електрически разряд; в блестящия спектър се оказаха много красиви оранжави и
жълти линии. Ние нарекохме този газ неон (нов). Накрая, при отделяне
на фракцията на криптона от аргона винаги оставаше неголямо мехурче, след като
всичкият криптон беше отделен вече от помпата. Този остатък показваше особен
спектър и ние го нарекохме ксенон (чужд)”.
Атомните маси на неона,
криптона и ксенона (респ. 20, 82 и 128) не могат да бъдат обяснени смислено с „уплътняване”
на известни елементи. Те не потвърждават и първоначалната хипотеза на Рейли и
Рамзи за съществуване на газова триада. Ето защо на този етап спорът се
ограничава до въпроса: трябва ли инертните газове да се поставят в VIII група?
Обоснован отговор дава белгийският
естественик Лео Ерера (1858-1905) в статия озаглавена „Магнетизъм и атомни маси” (1900). Сравнявайки магнитните свойства
на елементите по групи, той достига до извода, че мястото на инертните газове не
може да е в VIII група – нейните членове, за разлика от
инертните газове, притежават ясно изразени парамагнитни свойства. Затова Ерера
(независимо от Кистяковский) ги поставя в нова група – нулева. И те се задържат там (таблица 2) повече от 6 десетилетия.
4. Проблемът за редкоземните елементи
По времето, когато Менделеев
представя и усъвършенства своята таблица са известни ограничен брой
представители от серията елементи, наречени по-късно лантаноиди (Голдшмид,1925). Въпреки че Менделеев влага доста усилия
в опити за тяхното класифициране, задоволителното решаване на въпроса се отлага
значително във времето. Три са основните причини, затрудняващи намирането на
подходящи места на редкоземните елементи (РЗЕ):
1) Техните свойства са сходни.
Това изисква поставянето им в една група (но толкова дълга група в периодичната
система няма!);
2) Атомните маси на много от
тях са близки, което прави по-приемливо разполагането им в редица;
3) Данните относно това, дали
при експериментите са отделени нови елементи или някакви смеси (схема 1) са
несигурни. Затова прилагането на принципа
на атомната аналогия към РЗЕ няма
предсказателна сила и предизвиква допълнително объркване. Като илюстрация ще
посочим, че в периода от 1964 до 1905 г. за атомната маса на тербия са предлагани
9 различни стойности, вариращи в интервала 113 – 163,1.
Формално противоречието между
т. 1 и 2 е решено от немския учен И. Ретгерс през 1895 г. Той предлага вариант
на периодичната система, в която няколко РЗЕ са включени в една клетка от III-та група. Идеята му е развита няколко години по-късно от Богослав Браунер (1855-1935),
чешки учен, занимаващ се с мнимия РЗЕ „дидим” (схема 1). Браунер говори за особена
интерпериодна група, явяваща се продължение на IV-та група. В нея той поставя Ce, Pr, Nd, Sm, Tb, Er, Yb, както и др. елементи, чието съществуване е недостатъчно потвърдено
(таблица 2). Браунер допуска, че списъкът от РЗЕ може да се разшири, но не се
наема да прогнозира докъде. Тъй като това е важен теоретичен проблем започва
продължителна дискусия, която ще бъде разгледана по-нататък. Междувременно
интерпериодната група е върната отново в III група от Р. Майер през 1914.
5. Лъчите на Бекерел
През годината, в която И. Ретгерс
интуитивно предлага решение на проблема за редкоземните елементи, неговия
сънародник Вилхем Рьонтген (1845-1923) открива лъчи с неизвестна природа, които
нарича Х (хикс) (8.XI.1895). Два месеца по-късно на събрание на
Немското научно дружество, Рьонтген демонстративно използва новите лъчи за да
направи (рентгенова) снимка на ръката на проф. Кьоликер. Професорът е шокиран и
възторжено предлага за Х-лъчите ново име – рьонтгенови (бълг. рентгенови).
Сред учените, които се
захващат с хитовата тема за лъчите е и Анри Поанкаре (1854-1912). Той се
интересува от въпроса дали лъчи, подобни на рентгеновите не се излъчват от
флуоресцентните тела под действието на светлината. Привлечен от същия проблем,
Антоан Бекерел (1852-1908) изследва една флуоресцираща сол на урана (калиевo-уранил сулфат K2SO4.UO2SO4.2H2O). Той я излага на слънце, очаквайки
УВ-лъчите да възбудят флуоресценция, след което я завива в черна хартия, заедно
с фотографска плака. По евентуалното осветяване на плаката Бекерел смята да
докаже, че пробата изпуска ренгенови лъчи. Първите резултати от експеримента са
обнадеждаващи – плаката действително се осветява. Бекерел няма търпение да
продължи опитите си, но е забавен от метеорологичните условия (февруари 1896).
Принуден да чака слънчево време, той прибира парченцата уранова сол в същия шкаф,
в който са и плаките. След няколко дни бездействие, нетърпеливият учен решава
да прояви една плака, ръководен от хрумването, че някакви следи от рентгенови
лъчи може все пак да са се регистрирали, дори и без слънце. В резултат на този
„излишен труд” Бекерел установява, че плаката е осветена от някакво странно
твърдо лъчение, различно както от флуоресценцията, така и от слънчевата светлина.
Внимателният и безпристрастен анализ на фактите, както и серията допълнителни
изследвания му позволяват да направи откритие достойно за Нобелова награда:
урановите соли спонтанно изпускат лъчи с непознати свойста. Тези лъчи не се
променят при физични (нагряване, промяна на налягането) и химични въздействия,
не се наблюдава намаляване на тяхната интензивност с течение на времето и като
че ли енергията им произлиза от неизчерпаем източник.
6. Синовете на Кюри
Скоро след откриването на лъчите на Бекерел младата полска физичка
Мария Склодовска-Кюри (1867-1934), съпруга на Пиер Кюри (1859-1906), неин
научен ръководител в парижката школа по физика и химия, се заема с изучаването
им. Тя започва докторска дисертация (1897), която има небивал успех и носи на
своята авторка две Нобелови награди: 1) по физика (съвместно с А. Бекерел и П.
Кюри, 1903) за изучаването на явлението радиоактивност (термин, предложен от
нея, произлизащ от латинското radio – изпускам лъчи); 2) по химия – „за откриването на радия и
полония, за изолирането на радия и изучаването на
природата на този забележителен елемент” (1911).
Пътят към този успех обаче не
лесен. Той е изпълнен с младежки ентусиазъм, много труд, лишения и жертвоготовност
в името на науката. В началото Мария се заема да измери излъчването на урана с
помощта на пиезоелектричеството, открито през 1880 г. от нейният съпруг и брат
му Жак. Системата, която използва (камера за йонизация, електрометър и кварцов
кристал) дава толкова забележителни резултати (въпреки мизерното помещение, където
влагата е постоянен спътник, а температурата понякога спада под нулата), че
съпругът и без да се колебае изоставя всичките си изследвания в областта на
кристалите и се посвещава изцяло на новата тематика – радиоактивността. След като Мария твърдо установява, че
интензивността на излъчването на уранови и ториеви
минерали е пропорционална на количеството на радиоелемента в пробата, съпрузите се оказват изправени пред обещаващ
научен проблем: „... Два уранови
минерала: пехбленда (уранов оксид) и халколит (уранилмеден фосфат) са много
по-активни от самия уран. Този факт е много важен и дава основание да се вярва,
че тези минерали могат да съдържат елемент, много по-активен от урана.” (Мария
Кюри; из отчет на заседанието на Академията, 12 април 1898 г.). Сем. Кюри се
насочват към пехблендата при търсенето
на активното вещество. Тази суровина се оказва четири пъти по-радиоактивна от
чистия U3O8, който трябва да съдържа. Те търпеливо провеждат своите изследвания, прилагайки трудоемък нов метод
за разделяне и измерване на радиоактивността на получените съставки. С течение
на времето, забелязват, че радиоактивността се съсреодоточава главно в две от
химичните фракции получени при преработката на рудата. За тях това е знак, че в
пехблендата се съдържат два различни нови елемента. През юли 1898 те съобщават част
от откритието си: „... Мислим, че
веществото, което извлякохме от пехблендата съдържа един неотбелязан метал,
сроден с бисмута по своите аналитични свойства. Ако се потвърди съществуването
на този нов метал, предлагаме да се нарече полоний, по името на родината на единия от нас”. Другата част те обявяват
през декември същата година: „...
Различните причини, които изброихме ни карат да вярваме, че новото радиоактивно
вещество съдържа нов елемент, на който предлагаме да се даде името радий.
Новото радиоактивно вещество съдържа сигурно голяма пропорция барий, въпреки
това радиоактивността е значителна. Радиоактивността на радия трябва, прочее,
да е огромна.”
За да докажат на скептиците,
че радият наистина съществува сем. Кюри работят усилено още четири години. Като
начало те решават важни организационни въпроси: 1) Доставят от Чехия 1 тон руда
(отпадък от стъкларската индустрия); 2) Успяват
да намерят една порутена дървена постройка,
в която да извършват обработката и; 3) Обучават ученици, за да набавят така необходимите
за начинанието им средства. „Нямахме
пари, нямахме лаборатория, нито помощ, за да изкараме на добър край тази важна
и трудна задача” – пише по-късно Мария – „Сякаш създавахме нещо от нищо ... При все това, в този жалък хангар протекоха
най-хубавите и най-щастливите години на нашия живот, изцяло посветени на
работа. Често аз приготвях там нещо за ядене, за да не става нужда да
прекъсваме някоя особено важна операция. Понякога прекарвах целия ден в бъркане
на една вряща маса с железен прът, голям колкото мене. Вечер бивах смазана от
умора ...” В крайна сметка успяват да изолират 0,1 г. радий (1902). Неговите
свойства са толкова удивителни, че революционализират научния свят. Радият е два
милиона пъти по-радиоактивен от урана. Той спонтанно отделя топлина и светлина.
„Неговата светилност – пише Мария – не
може да се наблюдава на силна дневна светлина, но се вижда лесно в полумрака.
Излъчваната светлина може да се окаже достатъчно силна, за да може човек да
чете, като осветява с малко от това вещество”. Освен че влияе на фотографските
плаки през черна хартия и прави атмосферата електропроводима, радият кара голям
брой тела да фосфоресцират,
обагря в лилаво стъклените приемници,
разяжда и постепенно превръща в прах хартията и памука, с който го обвиват. Невъзможно
е да се остави предмет, растение или животно в близост до радий, без те да
придобият забележима активност. Неговото физиологично действие, може да е
полезно (използва се за лечението на редица форми на рака – кюритерапия), но причинява на Мария Кюри
коварна и неизвестна на медицината болест (злокачествена анемия), довела до
смъртта й (1934).
Славата, която радият и
полоният донасят на своите „родители” се оказва нежелан „страничен ефект” за съпрузите
Кюри. Огромната популярност и почестите
са бреме за тях, което ги откъсва от призванието им на експериментатори.
Богатството (въпреки, че е най-прекият път за осъществяване на мечтата им за
истинска лаборатория)
също не ги блазни. Ето защо Мария и Пиер, подобно на Рьонтген, не пожелават да
патентоват тайните си. „Физиците печатат
всякога своите изследвания изцяло” – казва Мария – „и ако нашето откритие има
търговско бъдеще, то това е случайност, която не бива да използваме. А радият
ще служи за лечението на болни... Струва ми се, че не е възможно да извличаме
някаква облага от това...”.
7. Атомът – сложна частица
Изучаването на
радиоактивността е последен етап от веригата научни събития отпращащи класическите далтонови представи за
неделимост на атома в историята. Първите данни за сложния строеж на атома са
представени още през трийсетте години на XIX век от Майкъл Фарадей (1791-1867) в неговите количествени
закони на електролизата:
1) Количеството разложено
вещество при електролиза е пропорционално на количеството преминало
електричество (1-ви закон на Фарадей);
2) При едно и също количество
електричество, преминало през различни разтвори, степента на разлагане е
пропорционална на химичния еквивалент на отделения елемент или група (2-ри
закон на Фарадей).
Дълго време (шест десетилетия)
тези закони не могат да се вплетат в някаква фундаментална теория, но тяхното значение
изкристализира през 70-те години на XIX век в идеята на Джордж Стоуни (1826-1911) за съществуване на елементарен електрически заряд (който е
част от атома). Стоуни изчислява, че
този заряд (атом на атрицателното
електричество) е равен на 10-20 C (1881) и го нарича по-късно електрон (1891).
За изясняването на химикоелектричните
явления по времето на Стоуни са от важно значение и експериментите с два типа
лъчи – катодни лъчи (открити от В.
Гиторф, 1869) и канални (анодни) лъчи
(открити от Е. Голдщайн, 1886) (фиг. 1). Катодните лъчи се оказват поток от
отрицателно заредени частици – електрони, а каналните – от положително заредени
частици (атоми на положителното
електричество или катиони).
Между тези носители на отрицателно и положително електричество се забелязват
важни разлики, позволяващи теоретизиране на различни нива:
1) Отношението заряд/маса (е/m) за електроните не се изменя при замяна на газа в
тръбата с друг газ (Дж. Томсън и Е. Вихерд, 1897), докато отношението е/m за катионите се променя;
2) Отношението е/m за катионите е значително по-малко, в
сравнение с това за електроните (В. Вин, 1897).
От т. 1 се прави извода, че
електрони се съдържат във всички елементи (Дж. Томсън), докато „атомите на
положително електричество” са различни, в различните газове. Освен това те са
много по-тежки от електроните (извод от т. 2). Най-лекият катион – водородния (наречен
от Ръдърфорд през 1920 г. протон – от
гр. BD@J@H – първи) се оказва около 2000 пъти по-тежък от
електрона (Дж. Томсън).
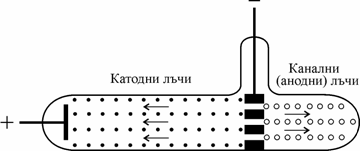
Фиг. 1. Устройство на газоразрядната тръба на
Голдщайн за получаване на катодни и канални лъчи. Катодът е поместен в средната
част на тръбата и е снабден с отвори (канали),
през които преминават положително заредени частици, получени от газовите
молекули или атоми под действието на катодните лъчи (електроните).
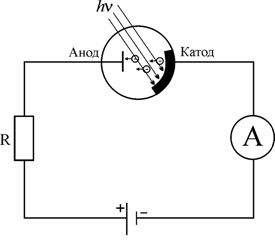
Фиг. 2. Схема с която може да се
регистрира явлението външен фотоефект, открито от Х. Херц (1887). Ако даден
метал, представляващ катод се облъчи с подходяща светлина от неговата
повърхност се отделят електрони, които се отправят към анода. Възникналият
фототок се отчита от амперметър.
Изследванията върху фотоелектричния
ефект (фиг. 2) (Ф. Ленард, 1902) и радиоактивността подкрепят и уточняват формираните
убеждения за сложността на атомната частица. През 1899 Ърнест Ръдърфорд
показва, че урановите атоми изпускат два типа лъчи, които се отклоняват в
магнитно поле в различни посоки. Той ги означава с гръцките букви a и b (фиг. 3). Една година по-късно П. Вийар открива и
трети вид радиоактивно излъчване – нарича го g (вж фиг. 3). Мария Кюри доказва, че a-лъчите представляват поток от материални частици (1900), а идентичността на
тези частици с двукратно йонизирани хелиеви атоми е установена по-късно
(1906-1909) от Ръдърфорд. b-Лъчите се оказват еднакви по природа с
катодните лъчи (А. Бекерел; 1900) и представляват поток от бързи електрони. g-Лъчите не се влияят от магнитно поле, приличат на рентгеновите лъчи и могат
да се разглеждат като светлина с много висока енергия.
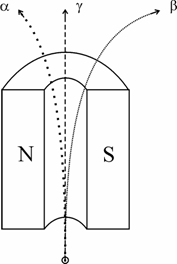
Фиг. 3. Разцепване на радиоактивното
лъчене в магнитно поле
8. Първите атомни модели
На базата на наличните
сведения в началото на XX век възникват първите предположения за строежа на атома.
През 1902 г. лорд Келвин (Уйлям Томсън,
1824-1907) предлага кексовия модел на
атома (фиг. 4 a). Според
този модел електроните са равномерно разпределени в положително заредена
материя, подобно на стафиди в кекс.
Изучавайки разпространението
на катодните лъчи в газове Филип фон Ленард (1862-1947) стига до извода (1903),
че атомът е съвкупност от електронеутрални дублети, наречени динамид. В тези дублети е съсреодоточена
цялата маса на атома, но те имат изключително малки размери и заемат нищожна
част от обема му (!) (фиг. 4 b).
През 1904 г. се появяват два
атомни модела – сатурновият модел на
Хантаро Нагаока (1865-1950) и моделът на Дж.
Томсън.
Според Нагаока атомът представлява
масивно, положително натоварено ядро около което обикаля електронен пръстен
(фиг. 4 c). Въпреки, че сатурновият модел е сходен
с бъдещия модел на Ръдърфорд той остава малкоизвестен.
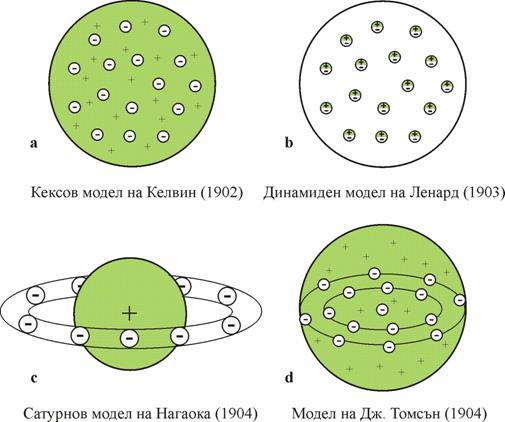
Фиг. 4. Първите
модели за строежа на атома
По-голямо впечатление на
научния свят прави моделът на Джозеф Джон Томсън (1856-1940) (фиг. 4 d). Според този учен атомът е електронеутрална система, наподобяваща капка
от положително електричество (с радиус около 10-8 см), в която „плуват”
съответен брой електрони. Те се разполагат в една плоскост по строго определен
начин, определящ химичните свойства на атома и обуславящ мястото му в
периодичната система (!!!). Томсън за пръв път разделя електроните на групи и
употребява понятието електронна конфигурация. А обяснението на самите спектри е
близко до това дадено от Нагаока: в случай, че нещо изведе електроните от
равновесното им състояние те започват да трептят, което се съпровожда с
излъчване.
Въпреки че експериментите на
Ръдърфорд в периода 1906-1909 г. показват несъстоятелността на някои от
твърденията в трудовете на Дж. Томсън, Нийлс Бор ги оценява високо с думите „те съдържат
много оргинални мисли и оказват голямо влияние на развитието на атомната теория”
Литература
1. Азимов А., Краткая история химии, изд. Мир, Москва
1983.
2. Азимов А., Пътеводител в науката. Физически науки,
изд. Наука и изкуство, София, 1989.
3. Александров
А., Обща химия, Пловдивско университетско
издателство, Пловдив 1998.
4. Большой энциклопедии Кирилла и Мефодия
-8 CD, 6-то издание 2002.
5. Борец
Т., Добър ден, господин Ампер, изд.
Техника, София, 1976.
6.
Данаилов Г., Нулевите, сп. Космос,
бр. 9, 1970, 27-30.
7. Джуа М., История химии, изд. Мир, Москва 1975.
8. Кедров Б.М., Прогнозы
Д.И. Менделеева в атомистике. Книга I.
Неизвестные
элементы, Атомиздат, Москва, 1977.
9. Кедров
Б.М., Три аспекта атомистики. Книга III. Закон Менделеева, изд. Наука, Москва, 1969.
10. Кедров
Б.М., Трифонов Д.Н., Закон периодичности
и химические элементы, изд. Наука, Москва, 1969.
11. Кюри
Е., Мария Кюри, библиотека Златни зърна, год. IV, кн. 1, 1939.
12. Larousse фамилна енциклопедия в единадесет тома, т. 3. Земята, вселената, открития, ICON Publishing House 2000.
13.
Левченков С.И., Модели строения атома,
http://ritz-btr.narod.ru/lenard.html
14. Ронков
Б., Обща химия, изд. Техника, София, 1985.
15.
Фигуровский Н.А., Открытие
элементов и произхождение их названий, Изд. Наука, Москва, 1970.