Част II. OТ ДАЛТОН ДО МЕНДЕЛЕЕВ
(вижте предишния материал)
1. Атомната теория на Далтон
2. Хипотезата на Праут за
единство на материята
3. Заслугите на Берцелиус
4. Реформата на Каницаро
5. Нов път за откриване на
елементи
6. Опити за установяване
на закономерност между атомната маса (еквивалентът) и химичното сходство
7. Периодичната система на
Менделеев
1. Атомната теория на
Далтон. След реформата на Лавоазие и дискредитирането на флогистонната
теория химията започва да се развива с бързи стъпки и навлиза в нов период
от своята история – периода на количествените закони. Началото на този
период е белязано с откриването на някои от най-важните химични закони,
свързани в една или друга степен с проблема за елементите – закона за еквивалентите
(1792-1802) на Рихтер, закона за постоянните отношения (1799-1806) на Пруст,
закона на кратните отношения (1802-1808) на Далтон, закона за простите
обемни отношения в съединенията между газове (1805-1808) на Гей-Люсак,
закона за изоморфизма (1818-1819) на Митчерлих и закона на Дюлонг и Пти
(1819). Изолирани са и значителен брой нови елементи – уран (1789), стронций
(1790), ниобий (1801), тантал (1802), родий, паладий и церий (1803), осмий
и иридий (1804), натрий, калий, калций, магнезий, барий и бор (1807-1808),
йод (1811), селен, литий, кадмий (1817).
Сред най-авторитетните фигури в химичния
свят по това време се нарежда английският учен Джон Далтон (1766-1844).
Изхождайки от идеята за корпускулярния строеж на материята и основавайки
се на развитото от Лавоазие понятие за химичен елемент, той разработва
т. нар. атомна теория, в която използва терминът атом, въведен още от Демокрит.
В своето основно произведение „Нова система на химичната философия” (1808-1827)
Далтон приема, че всеки химичен елемент се състои от свой собствен вид
атоми, характеризиращи се със съвкупност от свойства, сред които важно
място заема масата (теглото). За Далтон основната разлика между атомите
на различните елементи е масата. Той счита, че абсолютната маса не може
да бъде определена експериментално, но успява да изчисли относителната
маса на атомите спрямо най-лекия сред елементите – водорода. За целта той
намира масовите отношения между съставните части на дадено водородно съединение
и използва следните правила:
1) Ако две вещества образуват само едно съединение помежду си, трябва да се предполага, че то е с „двоен” атом (т.е. с отношение между компонентите 1:1).
2) Ако е известно, че се образуват две съединения, то може да се допусне, че едното е с „двоен”, а другото с „троен” атом (т.е. с отношение между компонентите 1:1 и 2:1).
3) Ако могат да се получат три съединения, то едното трябва да е с „двоен” атом, а другите две с „троен” атом (т.е. с отношение между компонентите 1:1, 2:1 и 1:2) и т.н.
В случай, че даден елемент не е способен да образува водородни съединения, Далтон определя неговата маса след като го свърже с елемент, чиито водородни съединения са добре известни.
Относителните атомни маси Далтон помества в таблица (вижте таблица 1). Въпреки че данните в нея са силно занижени (поради произволно формулираните правила 1-3) тя е с голямо историческо значение.
Таблица 1. Относителни атомни маси
по Далтон (1810) и Берцелиус (1829) (за сравнение са включени и атомните
маси приети днес)
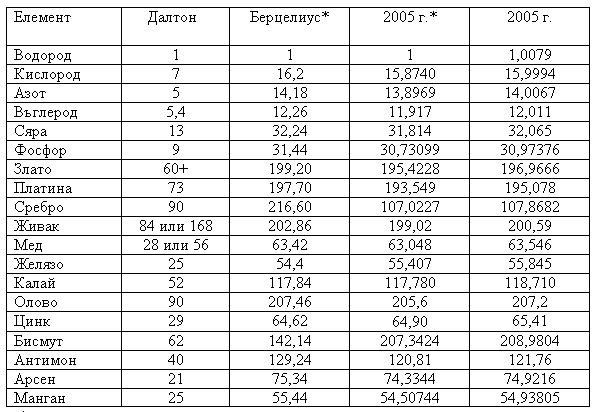
* - преизчислени така, че атомната маса
на водорода да бъде единица.
За нагледно представяне на „простите” и „сложни” атоми Далтон си служи с химични символи (рисунка 1). Той изключва светлината и топлорода от списъка на елементите, но не е готов докрай да отхвърли погрешните представи на Лавоазие за същността на топлината. По тази причина в своите схеми Далтон изобразява атомите заедно с ореол от „свързана топлина” (рисунка 2).
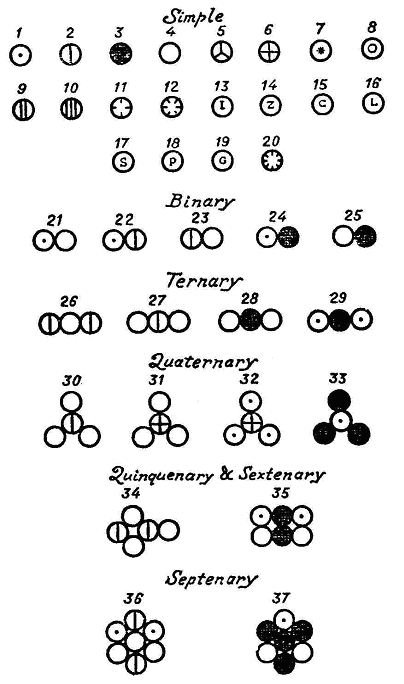
Рисунка 1. Символи на „прости” (1-20) и „сложни” (21-37) атоми по Далтон (1808-1810). 1 – водород, 2 – азот, 3 – въглерод, 4 – кислород, 5 – фосфор, 6 – сяра, 7 – магнезия, 8 – вар, 9 – натрий, 10 – калий, 11 – стронций, , 12 – барит, 13 – желязо, 14 – цинк, 15 – мед, 16 – олово, 17 – сребро, 18 – платина, 19 – злато, 20 – живак, 21 – вода (съставена от един атом водород и един атом кислород), 22 – амоняк (съставен от един атом водород и един атом азот), 23 – селитрен газ (азотен оксид; съставен от един атом азот и един атом кислород), 24 – маслороден газ (етилен; съставен от един атом въглерод и един атом водород), 25 – въглероден оксид (съставен от един атом въглерод и един атом кислород), 26 – диазотен оксид (съставен от един атом кислород и два атома азот), 27 – селитрена киселина (азотна киселина; съставена от два атома кислород и един атом азот), 28 – въглеродна киселина (съставена от два атома кислород и един атом въглерод), 29 – блатен газ (метан; съставен от един атом въглерод и два атома водород), 30 – перселитрена киселина (съставена от три атома кислород и един атом азот), 31 – сярна киселина (съставена от един атом сяра и три атома кислород), 32 – сяроводород (съставен от един атом сяра и три атома водород), 33 – спирт (съставен от три атома въглерод и един атом водород), 34 – селитрениста киселина (съставена от един атом селитрена киселина и един атом селитрен газ), 35 – оцетна киселина (съставена от два атома въглерод и два атома вода), 36 – амониев нитрат (съставен от един атом азотна киселина, един атом амоняк и един атом вода), 37 – захар (съставена от един атом спирт и един атом въглеродна киселина).
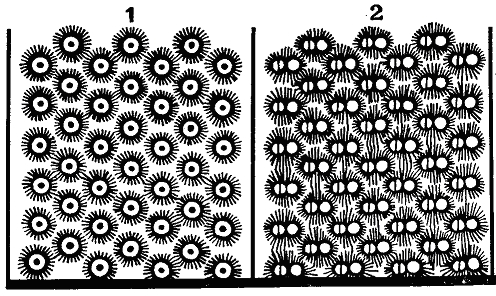
Рисунка 2. Схема на Далтон показваща частици водород (1) и азотен оксид (2) в „топлинна атмосфера”.
2. Хипотезата на Праут за единство на материята. Забелязвайки, че почти всички атомни маси в далтоновата таблица са цели числа английският лекар Уйлям Праут (1785-1850) поставя под съмнение концепцията, че атомите на всички елементите са неделими, неизменни и абсолютно независими един от друг. През 1815-1816 г. той изказва своята хипотеза за единство на материята, според която атомите имат сложен строеж и могат да се разглеждат като получени при кондензация на водород (първична материя). Хипотезата на Праут предизвиква широк отзвук в научния свят. Много водещи изследователи се стараят да я докажат или отхвърлят провеждайки все по-прецизни експерименти, целящи да се установи дали наистина атомните маси са цели числа. В крайна сметка хипотезата на Праут е изоставена и дори осмяна. Тя обаче получава нов импулс с откриването на явлението радиоактивност осем десетилетия по-късно.
3. Заслугите на Берцелиус. Голяма заслуга за оборването на хипотезата на Праут има шведският химик Йонс Якоб Берцелиус (1779-1848). Неговото име днес се свързва и с въвеждането на съвременната химична символика , създаването на дуалистичната система, според която елементите се класифицират на електроположителни и електроотрицателни (таблица 2), както и с откриването на елементите церий (1803), селен (1817), силиций (1824) и торий (1828).
Таблица 2. Електрохимичната класификация на Берцелиус.
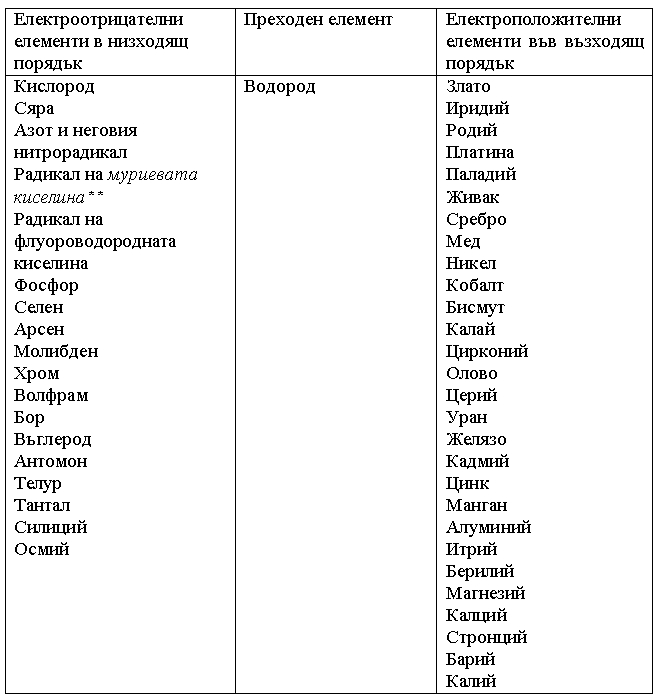
* Берцелиус (1814) значително
опростява химичните символи на елементите, в сравнение с Далтон, използвайки
само началните букви на латинските им наименования. За указване на състава
на съединенията той използва индекси, а химичните формули обединява в уравнения,
които изравнява с помощта на коефициенти в съгласие със закона за запазване
на веществото.
** Муриева киселина – солна
киселина. Берцелиус следва линията на Лавоазие и счита, че всички киселини
съдържат кислород, въпреки че Дейви, Гей-Люсак и Тенар категорично показват
чрез своите изследвания, че хлорът е елемент, а не окислен радикал.
Берцелиус работи мащабно върху проблема за определянето на атомните маси и в повечето случаи постига висока точност (вземайки под внимание техническите средства с които е разполагал). През периода 1818-1829 г. той публикува последователно няколко таблици на атмните маси , с които категорично показва, че атомните маси не са цели числа. В тези таблици обаче някои от атомните маси са двукратно завишени или занижени. Основната причина за това е, че той не приема хипотезата на Авогадро (1776-1856), според която най-малките самостоятелно съществуващи частици на простите газообразни вещества не са атоми, а групировки от атоми (молекули). Тази хипотеза изглежда абсурдна за Берцелиус, защото противоречи на дуалистичните му представи , изключващи възможността за обединяване на еднакви атоми.
4. Реформата на Каницаро. Макар че Авогадро излага своята молекулна хипотеза достатъчно ясно и нееднократно (1811, 1814, 1817, 1821), тя остава почти неизвестна за химиците и тъне в забрава близо четири десетилетия. Трудовете на Авогадро са забелязани едва след смъртта му. Подготвяйки своя лекционен курс по теоретична химия (1858) неговият съотечественикът Станислао Каницаро (1826-1910) се натъква случайно на тях и след осмислянето им ясно раграничава безразборно употребяваните от много автори понятия атом, молекула и еквивалент.
Трябва да отбележим, че още през четиридесетте години на XIX век френските химици Шарл Жерар (1816-1856) и Огюст Лоран (1807-1853) разграничат тези понятия, отстранявайки някои от неточностите в представите на Берцелиус. Така например Жерар коригира формулите на хлороводорода (HCl вместо H2Cl2), амоняка (NH3 вместо N2H6) и др. вещества, но считайки, че металните оксиди са близки по структура на водата погрешно приема, че металите образуват двуатомни молекули (както водорода). На базата на хипотезата на Авогадро (в равни обеми газове, при еднакво налягане и температура се съдържат еднакъв брой молекули), Каницаро се противопоставя на системата на Берцелиус, както и на споменатото неправилно схващане на Жерар. Той вярва, че молекулните маси са пропорционални на плътността на телата в газообразно състояние и след като приема (по подобие на Авогадро), че масата на водородната молекула е 2 и използва метода на Жан Дюма (1800-1884) за определяне на плътност на пари (1826) съставя лишена от вътрешни противоречия таблица на молекулните маси.
Статията на Каницаро се появява през 1858 г. в италианското списание „Новият естествоизпитател”, но и тя остава малкоизвестна за широката химична общественост. Едва на свикания две години по-късно Първи международен конгрес на химиците (Карлсруе, Германия, 1860), където Каницаро е изключително активен, неговите виждания стават популярни. Той държи пламенна реч, в която убедително представя достиженията на Авогадро и Жерар, подкрепяйки ги с важни експериментални данни. И макар че на самия конгрес не се стига до съгласие по някои от въпросите, засегнати от Каницаро само няколко години по-късно неговата т. нар. атомна реформа става факт, а възгледите на неговите опоненти са изоставени.
5. Нов път за откриване
на елементи. По времето когато Каницаро започва своята реформа химиците
познават 57 химични елемента. Всички те са открити или с помощта на химични
взаимодействия или при електролиза на стопилки – плодотворен метод, използван
за пръв път от английския учен Хъмфри Дейви (1778-1829) през 1807 г.
Откриването на нови елементи е мечта за
много химици. Актът на откриване обаче не подлежи на планиране и зависи
от различни фактори: техническите възможности, теоретичната база, късмета
на изследователите и т.н. И докато през периода 1823-1844 са открити 10
нови елемента (Be, Al, Si, V, Br, Ru, La, Tb, Er и Th), следващите 15 години
са период на затишие. Тази сравнително дълъга пауза се обяснява както с
липсата на теоретични основания за това къде и какво да се търси, така
и с относителното изчерпеване на възможностите на споменатите два метода.
Нов тласък на развитието на изследванията,
свързани с откриване на елементи дават немските учени Роберт Бунзен (1811-1899)
и Густав Кирхоф (1824-1887). В края на петдесетте години на XIX век те
установяват, че при подходящи високотемпературни условия всеки химичен
елемент излъчва точно определен (характеристичен) набор от ивици (спектър),
по който той може да бъде идентифициран, дори да е в нищожна концентрация
или пък в космически обект. Изучавайки през 1860 г. със помощта на спекроскоп
(рисунка 3) спектрите на литий, натрий и калий Бунзен стига до извода,
че по всяка вероятност, трябва да съществува и четвърти метал от тази група,
с характеристичен спектър сходен с този на лития . И действително скоро
след това изследвайки минерални води от Дюркхайм Бунзен и Кирхоф забелязват
в спектъра на пробата две неизвестни сини спектрални линии, доказващи наличието
на нов елемент. Този елемент те наричат цезий (от лат. ceasius – небесносин).
Година по-късно в лепидолит от Саксония двамата учени откриват друг
нов елемент – рубидий. Приблизително по същото време Уилям Крукс (1832-1919)
открива елемента талий (в оловни камери от завод за производство на сярна
киселина), а през 1863 г. Ф. Райх (1799-1882) и асистентът му Х. Рихтер
откриват елемента индий в цинкова руда. Изброените три нови елемента, подобно
на цезия, получават имената си във връзка с цветовете на най-характерните
им спектрални линии: името на рубидия произлиза от лат. rubidus
(червен), на талия – от гръцкото талос (зелена клонка), а
това на индия – от багрилото индиго.
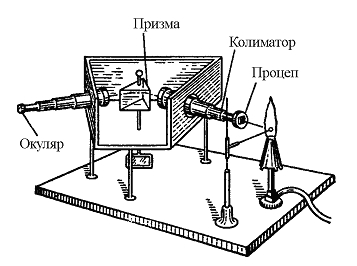
Рисунка 3. Схема на спектроскоп.
През следващите години спектралния анализ намира своето специфично място сред другите методи. С негова помощ са открити още много елементи – инертни газове, актиноиди и др. А самите спектри дават на изследователите обширен материал за разсъждения, довели по-късно до важни открития.
6. Опити да се установи закономерност между химичното подобие и атомните маси (еквивалентите). Когато Менделеев открива своя периодичен закон в края на 60-те години на XIX век идеята за съществуването на връзка между атомните маси (или еквивалентите) на някои подобни по химичните си свойства елементи съвсем не е нова. Още през 1829 г. немският химик Йохан Дьоберайнер (1780-1849) забелязва, че бромът притежава някои свойства (реактивоспособност, оцветяване), които са междинни на свойствата на хлора и йода, а атомната му маса е близка до полусумата от атомните маси на тази елементи. Дьоберайнер открива още три подобни семейства от три елемента, наречени триади: Li, Na, K; Ca, Sr, Ba и S, Se, Te. Въпреки търсенията си той не успява да намери други триади, а гениалната му наблюдателност е сведена до „забелязване на поредица от случайни съвпадения”. Значително по-късно (1857), с откриването на нови елементи и с решаване на някои от проблемите свързани с атомните маси са намерени още триади (Mg, Zn, Cd; Ce, La, Dy; Y, Er, Tb). Нещо повече – оказва се, че някои триади могат да се допълнят с и четвърти елемент (напр. магнезият може да се добави към поредицата Ca, Sr, Ba, а флуорът – към Cl, Br, I).
През 1857 г. английският учен У. Одлинг (1829-1921) решава да подреди елементите по нарастване на атомната им маса и съставя таблица, състояща се от 5 групи и 13 реда. Макар че тази таблица не изразява периодичността в свойствата на елементите, нито вътрешната връзка между тях в нея се наблюдават няколко групи от елементи с подобни химични свойства. През 1858 г. П. И. Петенкофер забелязва, че в някои от групите с химично сходни елементи съществува закономерна разлика между атомните маси. За изчисляване на атомните маси в такива групи Дюма съставя формули. Например за елементите F, Cl, Br, I формулата има следния вид: А = 19 + m16,5 + n28 (m = 0, 1 или 2; n = 0, 1, 2 или 3).
През 1862 г. Александър Шанкуртоа (1820-1886) в своето съчинение „Земна линия” нанася елементите на „винтова графика” в порядък на нарастване на атомната им маса и забелязва, че елементите с подобни свойства попадат в еднакви колони. Макар че някои елементи в графиката на Шанкуртоа са разположени неправилно, тя добре илюстрира наличието на обща закономерност (рисунка 4).
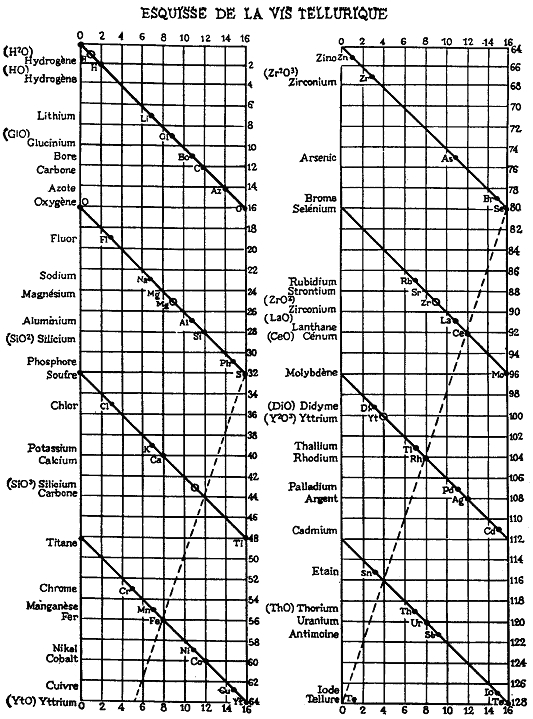
Рисунка 4. „Винтовата графика” на Шанкуртоа.
През 1865 г. Джон Нюлендс (1837-1898) забелязва, че свойствата на химичните елементи написани в порядък на нарастване на техните еквиваленти се повтарят през всеки седем елемента (табл. 3). Той нарича своето откритие закон на октавите, виждайки аналогия с музикалното понятие октава. За съжаление при докладването му на заседание на Лондонското химическо общество то е осмяно и отхвърлено.
Таблица 3. „Законът на октавите” на Нюлендс

Година преди това немският химик Лотер Майер (1830-1895) в своята книга „Съвременни теории в химията и тяхното значение за химическата статистика”, съставена в съответствие с реформите на Каницаро, помества няколко таблици, чрез които се стреми да съпостави групите от сходни елементи. В тези таблици, както и в по-късните си работи (най-известната от които е показана на рисунка 5), той не акцентира на най-съществената страна на вътрешната връзка между елементите – периодичната промяна на свойствата им. Въпреки, че рисунка 5 добре илюстрира това явление и изиграва положителна роля за по-лесното му възприемане руските автори единодушно твърдят, че Майер започва да говори за периодичност едва след като се запознава с публикациите на Менделеев. Освен това той, като че ли не вниква в дълбоката същност на менделеевия закон пишейки през 1870 г.: „Би било прибързано да се изменят приетите досега атомни маси [на In, Ce и U; б.а.] на базата на толкова колеблив опорен пункт.”
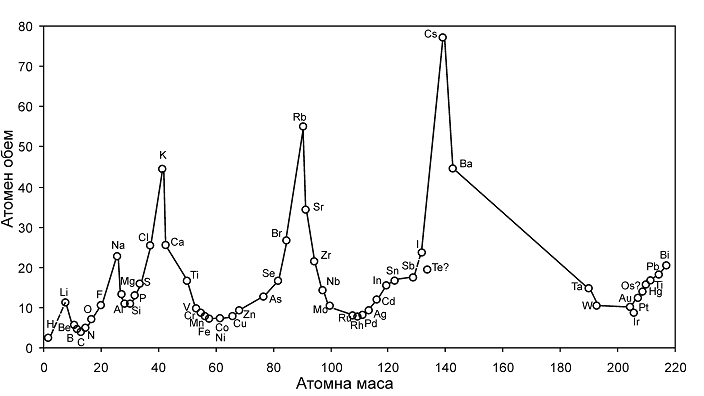
Рисунка 5. Зависимост между атомните маси и атомните обеми.
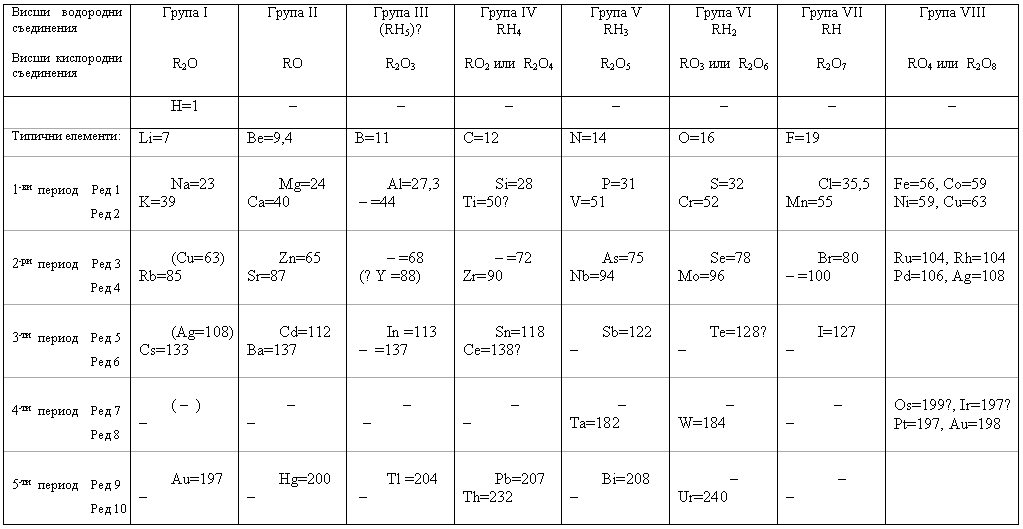
7. Периодичната система на Менделеев. За разлика от своите предшественици Менделеев търси връзката между всички елементи (а не само между сходните). Той отхвърля едностранчивостта и ограничеността при разглеждането на проблема и привлича на помощ голям брой физико-химичните данни, както и целия си предишен опит. „Решителен момент в развитието на мисълта ми за преиодичния закон – споделя Менделеев – смятам 1860 г. – конгреса на химиците в Карсруе, в който участвувах, и изказаните на този конгрес идеи от италианския химик С. Каницаро. Него смятам за истински мой предшественик, защото установените от него атомни тегла ми дадоха необходимата опорна точка ... и всъщност още тогава у мен изникна идеята за възможна периодичност в свойствата на елементите при увеличаване на атомното им тегло. Но спряха ме останалите несъобразности в приетите тогава атомни тегла; ясно остана само убеждението, че трябва да се работи в дадената насока” И Менделеев се захваща за работа. При подготовката на своя лекционен курс „Основи на химията” той насочва вниманието си върху факта, че валентността на елементите се променя периодично, при разполагането им в ред на нарастване на атомната маса. Подреждайки всичките познати до този момент елементи в семейства, подобно на Одлинг, Нюлендс и Майер той съставя таблица (17 февруари 1869), която озаглавява „Опит за система на елементите” (рисунки 6 и 7). В нея той избягва някои от недостатъците, характерни за таблиците на споменатите учени. Тя обаче, поставя редица допълнителни въпроси, по решаването на които Менделеев продължава да работи с усърдие. Той проверява атомните маси на 20 елемента и коригира приетите стойности за много от тях: Be, Ti, Y, In, La, Ce, Tl и U, изучава системно оксидите и оксидите-соли на елементите, занимава се с химията на редкоземните елементи. Във втората си публикация по темата озаглавена „Съотношение между свойствата и атомното тегло на елементите” Менделеев формулира няколко важни приложения и следствия на откритието си:
1) Свойствата на елементите се променят периодично с нарастване на атомната им маса;
2) Трябва да се очаква откриването на още много неизвестни елементи;
3) Атомната маса на елемента може понякога да бъде поправена, ако се знае неговия аналог.

Рисунка 6. Ръкопис на първата таблица на Менделеев (17 февруари1869).
На II конгрес на руските естественици и лекари (август 1969) Менделеев докладва съобщението „За атомния обем на простите тела” с което изпреварва известната публикация на Лотер Майер с около година. В този труд той съпоставя атомните маси и атомните обеми и стига до изводи, изцяло потвърждаващи периодичната закономерност.

Рисунка 7. Отпечатък на „Опит за система на елементите” (1 март 1869) изпратен от Менделеев на чуждестранни химици.
В периода 1870-1871 г. Менделеев пише две от най-значимите си статии: „Естествена система на елементите и приложението й за показване на свойствата на неоткритите елементи” и „Периодичната закономерност при химичните елементи”, които са плод на зрелите му размишления за периодичния закон. В „Естествената система” Менделеев включва таблица (вж. табл. 4), съдържаща 8 групи от елементи, чиято валентност спрямо кислорода се променя от 1 до 8 (в VIII група той обединява елементи с различна валентност). Редовете разделя на нечетни и четни, като подробно се спира на различията в свойствата на елементите в тях. Както Одлинг и Майер той разполага елементите в порядък на нарастване на атомната маса, но в някои случаи прави изключение следвайки естествения ред, определен от свойствата на елементите. За Менделеев свойствата на елементите са по-важни от атомната маса (която е възможно да е неточно определена), а като главен признак на понятието елемент той разглежда неговото място в периодичната система. Това място е еднозначно определено от две координати – номер на групата (ордината) и номер на реда (абциса). „Съдейки по всичко, което досега е известно – пише той – на всяко място в системата се пада само един елемент ...” Продължавайки своите разсъждения на базата на факта, че броя на местата е по-голям от броя на известните елементи Менделеев прави предположението, че съществуват елементи, които все още не са открити. Нещо повече – той изчислява атомната маса на тези елементи, дава им предварителни имена на основата на представка, заимствана от санскритския език – ека (напр. екабор, екасилиций, екаалуминий) и въвежда т.нар. принцип на атомната аналогия с чиято помощ смело си позволява да предскаже свойствата им. Това е нечувана за времето си научна дързост, която в началото почти не предизвиква положителни реакции от страна на научния свят. Някои „колеги” го съветват „да се залови за работа”, а други се усъмняват в приоритета му.
Все пак Менделеев получава признание. То идва внезапно и с парадокс. Менделеев, следейки внимателно новостите в химичната литература забелязва съобщението на френския химик Льокок дьо Боабодран (1838-1912), в който описва откриването (1875) на нов елемент, наречен галий. Менделеев веднага отъждествява този елемент с предсказания няколко години по-рано екаалуминий, но забелязва, че разликата между изчислената (5,9) и експериментално определената относителна плътност (4,7) е твърде голяма. Менделеев пише писмо на френския учен, в което му обръща внимание върху това разминаване в стойностите. След известно време Боабодран се запознава с работите на Менделеев, получава достатъчо количество галий и успява значително по-точно да определи относителната му плътност (5,94) .
Таблица 4. Периодичната система на елементите докладвана от Менделеев пред Руското химическо общество на 3(15) декември 1870 г. и публикувана през февруари 1871 г. в статията „Естествена система на елементите и приложението й за показване на свойствата на неоткритите елементи”.
Следват години на триумф на периодичния закон, а Менделеев и Боабодран се превръщат в най-цитираните автори. Но това е само началото. През следващото десетилетие предсказателния потенциал на периодичния закон се потвърждава още два пъти. През 1879 г. шведския химик Ларс Нилсон (1840-1899) открива елемента скандий (наречен от Менделеев екабор), а през 1885 г. Клеманс Винклер (1838-1904) открива елемента германий (екасилиций). Ето писмото, което немският учен пише на Менделеев по този повод:
„Уважаеми господине,
Позволете ми при това да Ви предам отпечатък от съобщението, от което следва, че съм открил нов елемент „германий”.
Отначало бях на мнение, че този елемент запълва празнината между антимона и бисмута във Вашата забележително прозорливо построена периодична система и че този елемент съвпада с вашия екаантимон, но всичко сочи, че си имаме работа с екасилиции.
Надявам се скоро да Ви съобщя по-подробно за това интересно вещество; днес се ограничавам само да Ви уведомя за твърде вероятния нов триумф на вашето гениално изследване и да Ви засвидетелствам своята почит и дълбоко уважение.
Ваш предан Клеманс Винклер
Фрайберг, Саксония, 26 февруари 1886”
(вижте другите учебни материали)
Литература
1. Джуа М., История химии, Изд. Мир, Москва 1975.
2. Азимов А., Краткая история химии, Изд. Мир, Москва 1983.
3. Фигуровский Н.А., Открытие элементов и произхождение их названий, Изд. Наука, Москва, 1970.
4. Кедров Б.М., Три аспекта атомистики. Книга III. Закон Менделеева, изд. Наука, Москва, 1969.
5. Кедров Б.М., Трифонов Д.Н., Закон периодичности и химические элементы, изд. Наука, Москва, 1969.
6. Кедров Б.М., Прогнозы Д.И. Менделеева в атомистике. Книга I. Неизвестные элементы, Атомиздат, Москва, 1977.
7. Фигуровский Н.А., Открытие элементов и произхождение их названий, изд. Наука, Москва, 1970.
8. Александров А., Обща химия, Пловдивско университетско издателство, Пловдив 1998.
9. Манолов К., Велики химици, изд. Народна просвета, София, 1982.
10. Большой энциклопедии Кирилла и Мефодия -8 CD, 6-то издание 2002.
11. Zumdahl S.S., Chemical Principles, 6th ed., Houghton Mifflin Company, Boston, New York, 2008.
Автор: д-р Кирил Гавазов
[ това е статия от брой 22 от август 2008 г. на списание "Коснос" www.kosnos.com ]