1. Топлина на образуване на едно химично съединение се нарича енталпията на реакцията на образуване на един мол на съединението от елементите (простите вещества), намиращи се в техните най-стабилни алтропни модификации при условията на реакцията. Например, при изгаряне на един мол въглеродни атоми (приблизително 12 g графит) се образува един мол въглероден диоксид, и топлината на тази реакция е топлината на образуване на въглеродния диоксид.
C(гр.) + O2(г.) = CO2(г.)
DH = - 94.05 kcal/mol, при p = 1 atm и T = 298.15 K
Отрицателния знак на изменението на енталпията на системата означава, че тя намалява, и следователно в околната среда се отделя топлина - т.н. екзотермична реакция. При DH > 0 реакцията се нарича ендотермична. Изменението на енталпията при постоянно налягане се свързва с изменението на вътрешната енергия чрез израза DH = DU + pDV, което означава, че част от изменението на енталпията отива и за извършване на работа от (при DV > 0) или срещу (при DV < 0) системата.
Когато налягането p = 1 atm и температурата T = 298.15 K (25 oC), топлината на образуване се нарича стандартна топлина на образуване и се отбелязва с DHfo (долен индекс еф от formation и горен индекс нула). За упростяване на изчисленията, стандартните топлини на образуване на простите вещества в техните най-стабилни алтропни модификации се приемат за равни на нула.
Само на малка част от химичните съединения могат да се определят топлините на образуване директно чрез измерване на топлината на реакцията на образуване съединението. При повечето съединения това става чрез измерване на топлините на изгаряне.
2. Топлини на химични реакции. За топлините на химичните реакции е изпълнен законът на Хес, който гласи, че топлината на една реакция не зависи от пътя, по който протича, а само от състоянието на реагентите и продуктите. Това означава, че сумата от топлините на следните две реакции:
C(гр.) + 1/2 O2(г.) = CO(г.)
CO(г.) + 1/2 O2(г.) = CO2(г.)
е равна на топлината на следната реакция:
C(гр.) + O2(г.) = CO2(г.)
която може да се разглежда като протичаща директно, или през двата стадия по-горе.
На практика двете реакции по-горе може да се сумират като алгебрични изрази, при което се съкращава CO(г.) от ляво и отдясно и се получава третата реакция.
Едно от следствията на закона на Хес е, че топлината на една реакция е равна на сума от топлините на образуване на продуктите, умножени по техните стехиометричните коефициенти в уравнението на реакцията, минус сума от топлините на образуване на реагентите, умножени по техните стехиометрични коефициенти. Например за реакцията
a A + b B + . . . и c C + d D + . . .
нейната топлина, DH, е равна на:
DH = c DHf(C) + d DHf(D) + . . . - (a DHf(A) + b DHf(B) + . . .)
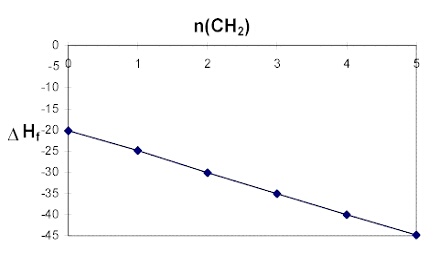
3. Изчисляване на топлините на образуване на алкани с помощта на адитивна схема. Този метод [1] позволява изчисляването на стандартната топлина на образуване на различните органични съединения. Необходимо условие за получаване на добра точност при тези изчисления е наличието на подходяща параметризация на добавките (инкрементите), които участват в съответните суми. Обикновено такава параметризация, с едни и същи инкременти, е възможна за даден клас съединения - напр. алкани, алкени, наситени алкохоли и пр. Идеята за една такава адитивна схема на изчисляване на топлината на образуване ни дават следните данни за топлините на образуване на нормалните алкани. На фигура 1 е представена зависимостта на топлината на образуване на етан, пропан, н-бутан, н-пентан, н-хексан и н-хептан от броя на метиленовите групи в тях, n(CH2) - съответно 0, 1, 2, 3, 4 и 5.

Почти идеалната права зависимост показва, че топлината на нормалните алкани може да се изчисли с много голяма точност по следната формула:
DHfo(CnCH2n+2) = -4.96 x n(CH2) - 20.12
Отрезът, -20.12, може да се тълкува като удвоената стойност на инкремента на метиловата група (CH3), понеже етанът е съставен от две метилови групи и нито една метиленова. Тогава, параметрично уравнение за топлината на образуване на нормалните алкани ще бъде:
DHfo(CnCH2n+2) = -4.96 x n(CH2) - 10.06x n(CH3),
което по нищо не се отличава от горното уравнение, понеже за нормалните алкани винаги n(CH3) = 2. Отличие има, ако се приложи това уравнение за разклонените алкани, които имат повече от две метилови групи, но тогава ще са необходими още два инкремента - този за метиновата група (>CH –) и този за четвъртично заместен въглероден атом (>C<).
Подобна адитивна схема на получаване на топлините на образуване на химичните съединения е възможна и чрез използване на инкременти по различните химични връзки. Например за алканите (нормални и разклонени) при използване на два инкремента, hC-H и hC-C , съответно по C-H и C-C връзките, тя би била следната :
DHfo(CnCH2n+2) = hC-H x n(C-H) + hC-C x n(C-H),
или като заместим броя на въглерод-водород връзките с 2n+2) и броя на въглерод-въглерод връзките с (n-1) се получава:
DHfo(CnCH2n+2) = hC-H x (2n+2) + hC-C x (n-1)
Експерименталните данни за стандартните топлини на горните пет алкана са следните [2]
------------------------
алкан DHfo(KCall/mol)
------------------------
етан
-20.24
пропан
-24.82
бутан
-30.15
пентан
-35.00
хексан
-39.96
------------------------
Изчислена по експерименталните данни за горните шест съединения зависимостта е:
DHfo(CnCH2n+2) = -3.79 x (2n+2) + 2.61 x (n-1) .
Използването на инкременти по броя връзки, обаче, довежда до еднакви топлини на образуване на различните изомери, понеже те имат еднакъв брой C–C и C–H връзки. На практика, тези изомери имат съществено различна топлина на образуване, ето защо схемата която използва инкременти по броя метилови, метиленови и пр. групи е по-адекватна. Реално и тази схема не отличава всички изомери, както се вижда от примера на 2-метилпентан и 3-метилпентан, които имат еднакъв брой такива групи.
В следващия материал от поредицата ще покажем как става на практика изчисляването на тези инкременти и колко добре тази елементарна адитивна схема предсказва количествените тендеции в стойностите на топлината на образуване на алканите.
Литература
1. В.А. Киреев, Методы практических расчетов в термодинамике химических реакции. Химия, Москва, 1975.
2. J.A. Dean (Ed.); Lange’s Handbook of Chemistry. McGraw-Hill, New York, 1972.
Автор: д-р Пламен Пенчев