Част 1. Увод
Основна задача на вибрационната спектроскопия е получаване на информация за състава, строежа и структурата на изследваното съединение. Решаването на тази задача се постига чрез възможно най-пълното и точно отнасяне на ивиците на спектъра. Под отнасяне се разбира намиране на съответствие между дадена спектрална ивица и породилото я молекулно трептене. Още в началото трябва да се изтъкне, че едно пълно отнасяне на всички ивици от наблюдавания спектър е възможно само за случаи на малки или високосиметрични молекули. За установяване строежа на неизвестни съединения са изключително полезни наличните данни от: елементния анализ, електронни и ЯМР-спектри, познаване на етапите на синтез и свойствата на съединението и др.
Отнасянето на ивиците във вибрационните спектри на химичните съединения се основава на следните критерии:
1. Характеристични, групови честоти. В повечето от случаите специалистът се задоволява с т.н. функционален анализ на химичното съединение, за което са достатъчни данните от характеристичните честоти.
2. Интензитет на ивиците. При практическата интерпретация на спектрите, когато отсъствуват резултати от вибрационните пресмятания, описаните за дадена характеристична група интензитети трябва да се възприемат предпазливо, тъй като те са дадени в рамките на определен тип съединения, т.н. относителни интензитети. Относителният интензитет на разглежданата ивица в спектъра на конкретна молекула може да се различава, понякога силно, от описания в литературата.
3. Форма на ивиците. В някои случаи характерната форма на ивиците, макар и слаби, има по-голяма доказателствена стойност при отнасянето им към дадено трептене, отколкото тяхното положение в спектъра. Контурът на ивиците в ротационно-вибрационните спектри на газовете дава директно информация за принадлежността на молекулата към определен тип симетрия.
4. Сравняване със спектри на аналогични съединения. Този начин на работа е много ефективен, особено когато съществува алтернатива за вида на неизвестното съединение или е на разположение спектрален атлас. За някои цели е достатъчно пряко сравнение между спектрите на изходното съединение и продукта на химичното превръщане.
5. Сравняване със спектри на изотопно заместени аналози. Това е един от най-еднозначните способи за отнасяне на ивиците. Най-голямо отместване претърпяват ивиците на трептенията, в които взема непосредствено участие изотопно белязаният атом.
6. Общ брой на наблюдаваните трептения.За една N-атомна нелинейна молекула са възможни 3N - 6 (3N - 5 за линейна) нормални трептения. Общият брой на ивиците може да надхвърли 3N - 6 (3N - 5 за линейните), в даден спектрален участък, ако се проявят обертонове и комбинирани честоти, както и разцепвания поради Ферми резонанс. Честотите на обертоновете и на съставните трептения трябва да се пресмятат, държейки сметка за тяхната симетрия и тази на съответната основна честота. Обикновено в спектрите се наблюдават по-малък брой ивици поради: нисък интензитет, израждане на трептенията, неактивност поради симетрични съображения, недобро разделяне, и други.
7. Подборни правила. В зависимост от типа на симетрия на молекулата някои от трептенията, понякога всички, са активни в инфрачервения и/или Раман спектъра. За молекули, притежаващи център на симетрия е в сила правилото за алтернативната забрана. Подборните правила трябва да се спазват и за наблюдаваните обертонове и Ферми-резонансни разцепвания.
8. Моделни пресмятания на вибрационни честоти и интензитети. Използват се само в случаите, при които се извършва пълен вибрационен анализ на молекулите.
Най-често използвани в практиката са първите четири критерия. На тяхна основа е построено и изложеното по-долу предписание за интерпретация на инфрачервени спектри. То се базира на обстоятелството, че трептенето на атомите в дадена характеристична група или структурен елемент пораждат няколко ивици едновременно в определени честотни интервали. Следователно присъствието на всички ивици, характерни за дадена група в спектъра на непознато съединение, доказва нейното наличието в изследваната молекула. Отсъствието само на една от ивиците отхвърля това предположение, при това с по-голяма достоверност.
Анализът на спектъра започва по принцип от високочестотната част, от ивиците съответстващи на валентните трептения. Причина за това е тяхната висока характеристичност, както и поради по-малък брой припокривания на ивици на различни трептения.
В началото е целесъобразно да се направи един бърз, ориентировъчен оглед на спектъра, като се обърне внимание на следните участъци: 3700-3200 сm-1, 2300-2000 сm-1 и 1800-1600 сm-1. Наличието на ивици в първата област дава основание да се предположи наличие на хидроксилни и/или амино групи в съединението. Отсъствието на ивици отхвърля това предположение. Основна опора в интервала 3100-2700 сm-1 е вълновото число 3000 сm-1. Наличието на ивици над тази стойност ни насочва към доказване на ароматни или олефинови въглеводороди, а под 3000 сm-1 към мастна верига. Присъствието на ивици между 2300 сm-1 и 2000 сm-1 показва, че съединението притежава почти сигурно1) някакъв вид тройна или струпани двойни връзки. Интензивни ивици в последния посочен интервал 1800-1600 сm-1 са резултат от трептенето на двойни C=O, C=N или С=C връзки.
Както се вижда, това най-бегло, първоначално запознаване със спектъра, ни насочва в общи линии към типа на изследваното съединение. Освен това придобитата информация ни предпазва от някои погрешни насоки при анализа, основаващи се на ивици, появата на които може да има алтернативно обяснение.
Както беше изтъкнато по-горе, за доказване на дадена характеристична група или структурен елемент се използуват последователно всички характеристични трептения, които й принадлежат. При анализа на тези взаимосвързани ивици често се налага прехвърляне на вниманието от една ивица към друга и обратно до пълно съгласуване на данните за положението, интензитета и формата на всяка от тях. Междувременно в подсъзнанието стоят наличните сведения за: фазово състояние, възможности за междумолекулни взаимодействия, влияние на разтворителя, електронни ефекти, възможни реакционни продукти в резултат на химичното превръщане, симетрия на молекулата и др., както и резултатите от първоначалния бърз оглед на спектъра. След обобщаване на всички данни за разглеждания молекулен фрагмент и доказването или отхвърлянето му той се запомня или по-добре записва, за да бъде използуван накрая за окончателно "конструиране" формулата на химическото съединение. Чак след приключване анализа на ивиците на един структурен елемент се пристъпва към разучаване характеристичните трептения на следващия. Накрая следва съгласуване на данните за отделните фрагменти и окончателно заключение за строежа и структурата на изследваното химично съединение.
Когато целта на регистриране на инфрачервения спектър е конкретна, отпада необходимостта от анализиране на всички ивици и вниманието се насочва към онези, които характеризират интересуващата ни функционална група или връзка. В такъв случай останалите точки от предписанието се пропускат.
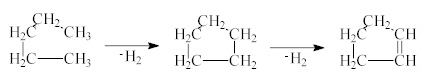
По правило елементния анализ трябва да предхожда измерването на инфрачервения спектър. Данните от брутната формула служат за определяне на еквивалентите на ненаситеност (ЕН), които дават предварително указание за типа на изследваното съединение. Като ЕН се дефинират двойните и тройни връзки и цикли в изследваното съединение. Всеки цикъл или двойна връзка съответствува на един ЕН. За тяхното създаване от съединението са отнети два водородни атома. Например при циклизацията на един парафин се отделят два водородни атома, при образуването на една двойна връзка също:

Броят еквиваленти на ненаситеност се пресмята по следния начин:
EH = [ (2n + 2) - S HE ] / 2
където: НE се нарича водороден еквивалент; НE = (2 - валентността на елемента); n - брой въглеродни атоми в съединението.
Присъствието на кислороден атом, съчетан с еквивалент на ненаситеност, насочва към предположение за присъствие на карбонилна група, а при липса на ЕН - към доказване на етерна или алкохолна група. Ако еквивалентите на ненаситеност на непознато съединение са повече от 4, това е указание за вероятно наличие на бензеново ядро и пр. Получените по този начин сведения служат като изходна информация при тълкуване на инфрачервените спектрите.
Често химикът се среща в своята работа със спектрите на съединения, елементния състав на които е неизвестен или пробата представлява смес от вещества. В някои случаи няма никаква информация, например при дешифриране на неизвестно химично съединение. При такива случаи изводите, направени само на основа на данни от ИЧ спектри, трябва да се правят предпазливо. Практиката показва, че понякога към дешифриране на спектрите се подхожда със силно желание за доказване на отнапред очакван резултат. При такава настройка и недостатъчно познаване ограниченията на метода, ИЧ спектроскопия предоставя големи възможности за самозаблуждение.
Абсорбциите на различните функционални групи и връзки в ИЧС на органичните съединения са дадени по-долу по класове. Посочени са характеристичните интервали, в които те се проявяват, заедно с някои техни особенности. Подчертани са онези от тях, на които би трябвало да се обърне по-особено внимание. След дяла въглеводороди е дадено предписание за интерпретация на ИЧ спектри, което обаче не трябва да се изпълнява безкритично. То трябва да се възприема само като илюстрация на един от възможните подходи, използвани при тълкувне на ИЧ спектри и има за задача само да помогне начинаещите по-бързо да изработят собствен стил за интерпретация. В дадените примери е посочен начинът на работа с предписанието. След общите указания за абсорбциите на останалите функционални групи са дадени също примери, при които е приложен аналогичен подход за тъклуване, макар отделните етапи да не са описани.
Литература
1. Г. Андреев. Молекулна спектроскопия, Изд. ПУ “П. Хилендарски”, Пловдив, 1999.
Автор: Проф. дхн Георги Андреев