Трептенето на двуатомните молекули се извършва по валентната връзка и то така, че центъра на масите остава непроменен. Запазване положението на центъра на масите е основно условие и при описание на трептенето на многоатомните молекули. В противен случай би се осъществило преместване на молекулата в пространството, така наречената транслация.Вибрационна спектроскопия
част 4Трептене на многоатомни молекули
1. Брой нормални трептения в една молекула. За да опишем транслационното движение на една молекула е необходимо да познаваме трите координати на центъра на масите. Ротацията на молекулата се описва също с три координати - трите Ойлерови ъгъла. Следователно центърът на масите на една нелинейна N-атомна молекула ще притежава общо 6 степени на свобода.
Положението на всеки атом се определя с три пространствени координати, атомът има три степени на свобода. Една N-атомна молекула ще притежава общо 3N степени на свобода. Тъй като 6 от тях описват движението на молекулата като цяло, за вътрешномолекулни движения на една N-атомна молекула (нелинейна) остават 3N - 6 координати.
Ако молекулата е линейна, за дефиниране на центъра на масите са нужни 3 координати, за определяне ориентацията на правата върху която лежат ядрата - 2, т.е. общо 5 координати за описание положението на молекулата като цяло. В такъв случай броят на вътрешномолекулните степени на свобода (трептения) на една линейна молекула ще бъде равен на 3N - 5.
За да остане центърът на масите непроменен, при всяко вътрешномолекулно трептене атомите трябва да се преместват с еднаква честота, достигайки едновременно максималните отклонения от равновесното си положение. Такива хармонични трептения, които не могат да се изразят едно чрез друго се наричат нормални трептения (независими). Една N-атомна молекула притежава 3N - 6 (съответно 3N - 5 за линейните) нормални трептения, всяко едно от които се извършва с постоянна амплитуда, различна за различните атоми.
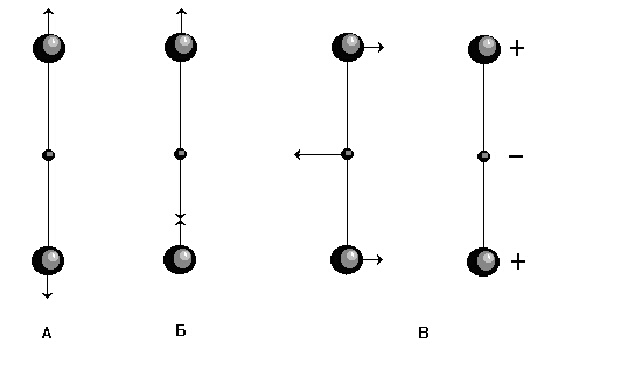
На фигура 1 са изобразени формите на нормалните трептения на газообразен серовъглерод, CS2. Под форма на нормално трептене се разбира знакът и амплитудата на трептенето: дължината на стрелките съответствуват на амплитудите, които са обратно пропорционални на масите.

В първия случай - фигура 1А, разтеглянето на серните атоми се извършва с еднаква честота и във фаза. Едновременното свиване на двата серни атома е вторият полупериод на това нормално трептене. Понякога последното се възприема погрешно от студентите като друго нормално трептене. Второто трептене ( фигура 1Б) се извършва също по валентите връзки; такива нормални трептения се наричат валентни (stretching) и се означават с n.
При извършване на валентното трептене (А), всички елементи на симетрия на молекулата се запазват, поради което то се нарича валентно симетрично, в конкретния случай - напълно симетрично. При нормалното трептене (Б) някои от елементите на симетрия на молекулата се нарушават, поради което то се нарича антисиметрично. Двете трептения се означават съответно с долните индекси "s" и "as": ns и nas.
Представените на фигура 1В две трептения са свързани с промяна на ъгъла между връзките. В единия случай промяната е представена в равнината на листа, а в другия - в равнина, перпендикулярна на нея. Тези нормални трептения се наричат деформационни (bending). Всъщност молекулата на CS2 може да се деформира в произволна равнина, перпендикулярна на междуядрената ос. Всяко от безкрайно големия брой деформационни движения на молекула от този вид може да се разглежда като резултат от суперпозиция на две нормални трептения, лежащи във взаимно перпендикулярни равнини. Тези две деформационни трептения са с една и съща честота (d = 397 сm-1), поради което се наричат изродени, в случая - двукратно изродени.
Пример за триатомна нелинейна молекула е водата, H2O; N = 3. При нея се очакват 3N - 6 = 3 нормални трептения. Двете от тях са валентни (ns и nas), третото (d) - деформационно - вижте фигура 2.
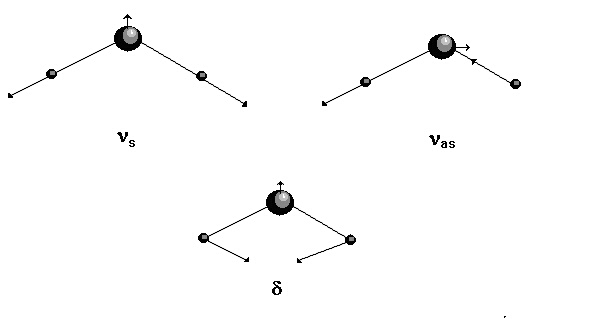
Симетричното и антисиметрично валентни трептения на водата, са свързани с промяна на диполния момент на молекулата. Ето защо и двете са активни в инфрачервената спектроскопия. Антисиметричното валентно трептене на CS2 (фигура 1Б) е също свързано с промяна на диполния момент, поради което е също инфрачервено активно. При симетричното движение на двата серни атома спрямо неподвижния въглероден атом (фигура 1А) диполният момент не се променя. Ето защо това трептене не може да бъде възбудено с инфрачервено лъчение, т.е. ns на CS2 е инфрачервено неактивно. То е обаче активно в Раман-спектрите.
Деформационните трептения както на водата, така и на CS2, са свързани с промяна на диполния момент, m, и са активни в инфрачервените спектри. Бележат се с d. Означението d се използува при т.н."ножични" деформационни трептения. За случая на многоатомни групи са възможни и други видове деформационни трептения - вижте фигура 2.
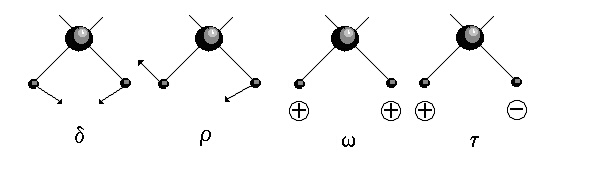
Когато молекулата има равнина на симетрия, една част от нейните трептения остават в тази равнина (2N - 3 на брой), докато останалите се извършват извън нея. Първите се наричат равнинни, вторите - извънравнинни деформационни трептения - фигура 3.
При реалните молекули, наред с преходите с Dn = +1 или Dn = +1, са разрешени също и преходи с Dn = +-2, +-3... Тези обертонови преходи се проявяват най-често в близката инфрачервена област (12500 - 4000 сm-1) и макар да са с един до два порядъка по-нисък интензитет от основните честоти представляват също интерес, защото съответните им ивици попадат в свободна от други абсорбции спектрална област. В случаите, когато един обертон се проявява в средната инфрачервена област, различаването на ивицата му от ивиците на основните честоти е доста трудно.
Наред с основните и обертоновите, понякога в спектрите се наблюдават и ивици, дължащи се на суми или разлики от две основни трептения - т.н. съставни честоти.
В добавка към обертоновите и съставни честоти понякога във вибрационните спектри се наблюдават т.н. случайни израждания на трептенията или Ферми-резонанс. Причина за този ефект е случайното съвпадане на един основен тон с един обертон или съставна честота, имащи различни форми на трептене. В резултат в спектрите се наблюдава разцепване на ивиците. При това обертонът или съставната честота "взема интензитет" от основния тон и двете ивици в дублета се проявяват с близки интензитети. Такова е например обяснението на дублета при 791/762сm-1 в инфрачервения спектър на CCl4, който е отнесен към Ферми-резонанс между nas и съставното трептене n* = ns(459 сm-1) + nas (315 сm-1). Трябва да се подчертае обаче, че основният тон и обертонът (съответно съставното трептение), встъпващи във Ферми-резонанс, трябва да принадлежат към трептения от един и същи тип на симетрия. Това обстоятелство се използува в някои случаи за изясняване симетрията на изследваната молекула.
Приблизителното положение на непертурбираната основна честота от Ферми-резонансния дублет може да бъде пресметната по формулата:
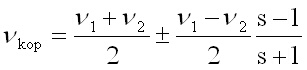 (1)
(1)
където n1 и n2 - наблюдавани честоти, а s = I1/I2, - отношение на интензитетите на ивиците.
От изложеното дотук следва, че в инфрачервения спектър на една относително малка органична молекула, например бензол, ще се наблюдават значителен брой нормални трептения (3x12 - 6 = 30 броя). Като добавим към тях и броя на възможните обертонови и съставни честоти, както и евентуални разцепвания поради Ферми-резонанс излиза, че такъв спектър ще се интерпретира много трудно. В действителност, броят на ивиците във вибрационните спектри на химичните съединения е много по-малък. Причините за това са следните:
1. Голям брой от ивиците на основните трептения са толкова слаби, че въобще не се наблюдават в спектъра.
2. Честотите на много основни трептения са толкова близки, че съответните ивици се припокриват.
3. Някои от основните трептения не попадат в средната инфрачервена спектрална област.
4. Обертоновите и съставни честоти имат с един до два порядъка по-нисък интензитет от този на основните.
5. Някои от трептенията на молекулите не са свързани с промяна на диполния момент, поради което те са неактивни. Броят на такива трептения е толкова по-голям, колкото по-висока е симетрията на молекулата.
Например в инфрачервения спектър на бензола от възможните 30 нормални трептения се наблюдават едва 4. Причина за това е фактът, че само 7 от основните му трептения променят диполния момент, а освен това три от тях са двукратно изродени.
2. Характеристични трептения. Още при първите системни изследвания на инфрачервените спектри на голяма поредица химични съединения е установено (Кобленц 1905 г.), че абсорбцията на някои функционални групи е свързана с поява на ивици в спектрите, положението на които не се променя значително, независимо от скелета на тези съединения. Такива ивици на функционални групи или връзки са наречени характеристични, а съответствуващите им честоти - характеристични или групови честоти.
Наличието на характеристични честоти е извънредно плодотворно обстоятелство, понеже то дава възможност да се правят заключения за вида на изследваните съединения само въз основа на вибрационните спектрални данни. Широкото използуване на инфрачервената спектроскопия (в голяма степен и на Раман-спектроскопията) се основава именно на характеристичните трептения. Характеристичност от теоретична гледна точка ще има в случаите, когато трептенето е изцяло локализирано върху даден молекулен фрагмент. Това е в сила в чист вид само при двуатомните молекули. Вибрационните трептения на многоатомните молекули показват, че почти винаги в трептенето на дадена характеристична група или връзка вземат участие голям брой силови константи.
При разглеждане на двуатомните молекули в хармонично приближение видяхме, че честотите им зависят от силовата константа k и приведената маса m (уравнение 4 в този материал). Локализацията на дадено трептене в една многоатомна молекула ще се осъществи при условие, че тези два основни фактора се различават значително от k и m на непосредствено свързаните с нея други групи и връзки. Първият случай се реализира при трептене на кратни връзки, свързани с прости връзки. Голямата разлика в силовите константи на двойните и тройните връзки (kC%C = 10x10-5 din сm-1, съответно kC=C = 15x10-5 dinсm-1) от тези на единичните (kC-C = 5x10-5 din сm-1), е причина за слабото взаимодействие между тях, следователно за високата им характеристичност. Простите връзки C-C,C-N,C-O имат близки стойности на своите k, поради което между тях се осъществяват вибрационни взаимодействия (в добавка, разликата в масите им е незначителна). Това е причина за ниската им характеристичност, следователно, за затруднения при интерпретация на ивиците им в областта на т.н. скелетни трептения на органичните съединения.
Локализация на дадено трептене ще се наблюдава и в случай, че редуцираната маса на дадената характеристична група се различава значително от масата на свързания с нея структурен елемент. . Такъв е случаят при групи, участие в които взема водороден атом (C-H, N-H, O-H, S-H и др.). Тъй като амплитудата на трептенето е обратно пропорционална на атомната маса, в характеристичното трептене X-H водородният атом ще трепти до слабоподвижния атом X. Именно слабата подвижност на атома Х ограничава предаването на движението към скелета на молекулата.
Ако обаче характеристичните ивици се проявяваха при едни и същи честоти, например, ако трептенето на C=O групата предизвикваше ивици винаги на едно и също място в спектъра, независимо от вида на съединението, вибрационните спектри не биха имали особена стойност. Оказва се, че положението и интензитетът на даденото характеристично трептене зависят от различни фактори; обратно - честотата и относителният интензитет на ивицата в спектъра дават възможност да се установи не само вида на характеристичната група, но и нейното обкръжение, взаимодействието и с други групи или молекули, състоянието и др. Ето защо, когато говорим за характеристични честоти, ще разбираме всъщност характеристични интервали, в които се проявяват ивиците на функционалните групи и връзки.
Нека припомним, че характеристичните трептения са нормални трептения, при които всички атоми на молекулата участват във всяко нейно трептене, макар с различна амплитуда. Това е причина за липсата на пълна характеристичност. Факторите, от които зависи положението на ивиците на груповите честоти, ще бъдат разгледани в една от следващите лекции.
Литература
1. Г. Андреев. Молекулна спектроскопия, Изд. ПУ “П. Хилендарски”, Пловдив, 1999.
Автор: Проф. дхн Георги Андреев